Immobilized CALB
CALB ແມ່ນ immobilized ໂດຍການດູດຊຶມທາງກາຍະພາບໃນຢາງທີ່ hydrophobic ສູງທີ່ເປັນ macroporous, styrene / methacrylate polymer.Immobilized CALB ແມ່ນເຫມາະສົມສໍາລັບຄໍາຮ້ອງສະຫມັກໃນສານລະລາຍອິນຊີແລະລະບົບທີ່ບໍ່ມີສານລະລາຍ, ແລະສາມາດນໍາມາໃຊ້ໃຫມ່ແລະນໍາມາໃຊ້ໃຫມ່ເປັນເວລາຫຼາຍໃນເງື່ອນໄຂທີ່ເຫມາະສົມ.
ລະຫັດສິນຄ້າ: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★ກິດຈະກໍາທີ່ສູງຂຶ້ນ, ການເລືອກ chiral ສູງຂຶ້ນແລະຄວາມຫມັ້ນຄົງສູງຂຶ້ນ.
★ປະສິດທິພາບທີ່ດີກວ່າໃນໄລຍະທີ່ບໍ່ມີນ້ໍາ.
★ເອົາອອກຈາກລະບົບຕິກິຣິຍາໄດ້ຢ່າງງ່າຍດາຍ, ຢຸດຕິກິຣິຍາຢ່າງໄວວາ, ແລະຫຼີກເວັ້ນການຕົກຄ້າງຂອງທາດໂປຼຕີນໃນຜະລິດຕະພັນ.
★ສາມາດເອົາມາໃຊ້ໃໝ່ ແລະ ນຳມາໃຊ້ຄືນໄດ້ເພື່ອຫຼຸດຕົ້ນທຶນ.
| ກິດຈະກໍາ | ≥10000PLU/g |
| ລະດັບ pH ສໍາລັບປະຕິກິລິຍາ | 5-9 |
| ຊ່ວງອຸນຫະພູມສໍາລັບປະຕິກິລິຍາ | 10-60℃ |
| ຮູບລັກສະນະ | CALB-IMMO100-A: ສີເຫຼືອງອ່ອນຫາສີນ້ຳຕານແຂງ CALB-IMMO100-B: ແຂງສີຂາວຫາສີນ້ຳຕານອ່ອນ |
| ຂະໜາດອະນຸພາກ | 300-500μm |
| ການສູນເສຍເວລາແຫ້ງຢູ່ທີ່ 105 ℃ | 0.5%-3.0% |
| ຢາງສໍາລັບ immobilization | Macroporous, styrene/methacrylate polymer |
| ທາດລະລາຍປະຕິກິລິຍາ | ນ້ໍາ, ສານລະລາຍອິນຊີ, ແລະອື່ນໆ, ຫຼືບໍ່ມີຕົວລະລາຍ.ສໍາລັບປະຕິກິລິຍາໃນບາງສານລະລາຍອິນຊີ, ນ້ໍາ 3% ສາມາດຖືກເພີ່ມເພື່ອປັບປຸງຜົນກະທົບຂອງປະຕິກິລິຍາ |
| ຂະໜາດອະນຸພາກ | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
ຄໍານິຍາມຂອງຫນ່ວຍງານ: 1 ຫນ່ວຍສອດຄ່ອງກັບການສັງເຄາະຂອງ 1μmol ຕໍ່ນາທີ propyl laurate ຈາກອາຊິດ lauric ແລະ 1-propanol ທີ່ 60 ℃.ຂ້າງເທິງ CALB-IMMP100-A ແລະ CALB-IMMO100-B ກົງກັນກັບຕົວຂົນສົ່ງທີ່ immobilized ທີ່ມີຂະຫນາດອະນຸພາກທີ່ແຕກຕ່າງກັນ.
1. ປະເພດເຄື່ອງປະຕິກອນ
enzyme immobilized ແມ່ນໃຊ້ໄດ້ກັບທັງເຕົາປະຕິກອນ kettle batch ແລະເຄື່ອງປະຕິກອນການໄຫຼຢ່າງຕໍ່ເນື່ອງຂອງຕຽງຄົງທີ່.ມັນຄວນຈະໄດ້ຮັບການສັງເກດເຫັນເພື່ອຫຼີກເວັ້ນການ crushing ເນື່ອງຈາກຜົນບັງຄັບໃຊ້ພາຍນອກໃນລະຫວ່າງການໃຫ້ອາຫານຫຼືຕື່ມ.
2. ປະຕິກິລິຍາ pH, ອຸນຫະພູມແລະສານລະລາຍ
enzyme immobilized ຄວນໄດ້ຮັບການເພີ່ມສຸດທ້າຍ, ຫຼັງຈາກວັດສະດຸອື່ນໆເພີ່ມແລະລະລາຍ, ແລະ pH ປັບ.
ຖ້າການບໍລິໂພກຂອງ substrate ຫຼືການສ້າງຜະລິດຕະພັນຈະນໍາໄປສູ່ການປ່ຽນແປງຂອງ pH ໃນລະຫວ່າງການຕິກິຣິຍາ, buffer ພຽງພໍຄວນໄດ້ຮັບການເພີ່ມເຂົ້າໃນລະບົບຕິກິຣິຍາ, ຫຼື pH ຄວນໄດ້ຮັບການຕິດຕາມແລະປັບຕົວໃນລະຫວ່າງການຕິກິຣິຍາ.
ພາຍໃນຂອບເຂດຄວາມທົນທານຂອງອຸນຫະພູມ CALB (ຕ່ໍາກວ່າ 60 ℃), ອັດຕາການປ່ຽນແປງເພີ່ມຂຶ້ນກັບການເພີ່ມຂຶ້ນຂອງອຸນຫະພູມ.ໃນການນໍາໃຊ້ພາກປະຕິບັດ, ອຸນຫະພູມຕິກິຣິຍາຄວນໄດ້ຮັບການຄັດເລືອກຕາມຄວາມຫມັ້ນຄົງຂອງ substrate ຫຼືຜະລິດຕະພັນ.
ໂດຍທົ່ວໄປ, ປະຕິກິລິຍາ hydrolysis ester ແມ່ນເຫມາະສົມໃນລະບົບໄລຍະທີ່ມີນ້ໍາ, ໃນຂະນະທີ່ປະຕິກິລິຍາການສັງເຄາະ ester ແມ່ນເຫມາະສົມໃນລະບົບໄລຍະອິນຊີ.ສານລະລາຍອິນຊີສາມາດເປັນເອທານອນ, ເຕຕຣາໄຮໂດໂຟຣານ, n-hexane, n-heptane ແລະ toluene, ຫຼືສານລະລາຍປະສົມທີ່ເໝາະສົມ.ສໍາລັບປະຕິກິລິຍາໃນບາງສານລະລາຍອິນຊີ, ນ້ໍາ 3% ສາມາດຖືກເພີ່ມເພື່ອປັບປຸງຜົນກະທົບຂອງປະຕິກິລິຍາ.
3. ການນຳໃຊ້ຄືນໃໝ່ ແລະ ຊີວິດການບໍລິການຂອງ CALB
ພາຍໃຕ້ເງື່ອນໄຂຕິກິຣິຍາທີ່ເຫມາະສົມ, CALB ສາມາດຟື້ນຕົວແລະນໍາໃຊ້ຄືນໃຫມ່, ແລະເວລາຄໍາຮ້ອງສະຫມັກສະເພາະແມ່ນແຕກຕ່າງກັນກັບໂຄງການທີ່ແຕກຕ່າງກັນ.
ຖ້າ CALB ທີ່ຟື້ນຕົວບໍ່ໄດ້ຖືກນໍາໃຊ້ຄືນໃຫມ່ຢ່າງຕໍ່ເນື່ອງແລະຕ້ອງການເກັບຮັກສາຫຼັງຈາກການຟື້ນຕົວ, ມັນຈໍາເປັນຕ້ອງລ້າງແລະຕາກໃຫ້ແຫ້ງແລະປະທັບຕາຢູ່ທີ່ 2-8 ℃.
ຫຼັງຈາກຫຼາຍໆຮອບຂອງການນໍາໃຊ້ຄືນໃຫມ່, ຖ້າປະສິດທິພາບຂອງປະຕິກິລິຍາຫຼຸດລົງເລັກນ້ອຍ, CALB ສາມາດຖືກເພີ່ມຢ່າງເຫມາະສົມແລະສືບຕໍ່ນໍາໃຊ້.ຖ້າປະສິດທິພາບຂອງປະຕິກິລິຍາຫຼຸດລົງຢ່າງຮຸນແຮງ, ມັນຈໍາເປັນຕ້ອງປ່ຽນແທນ.
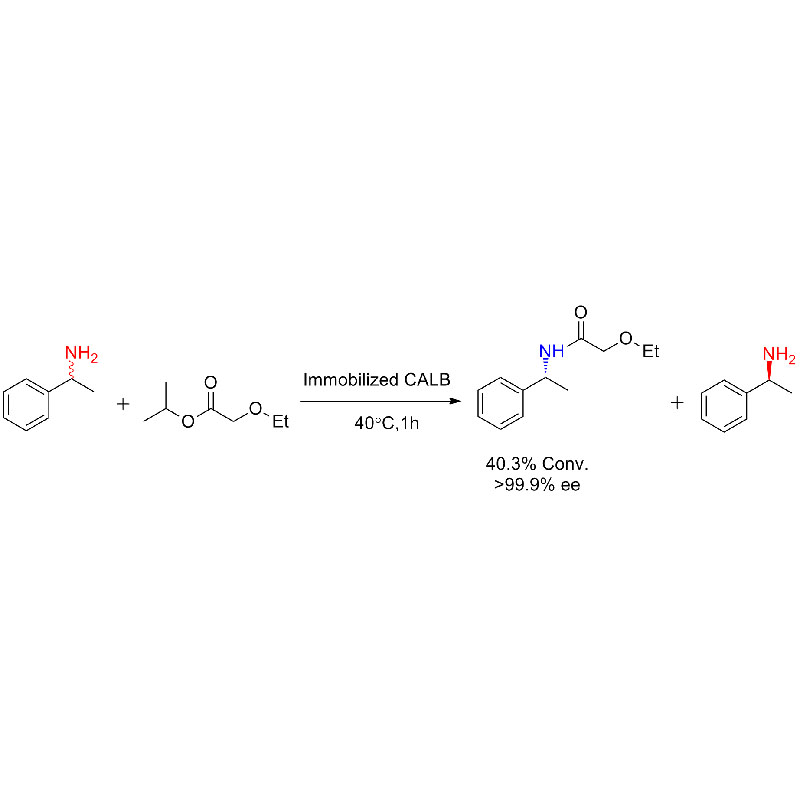
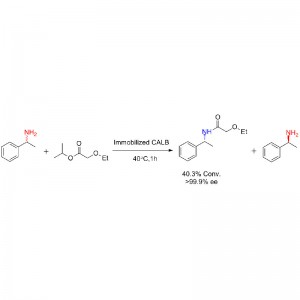
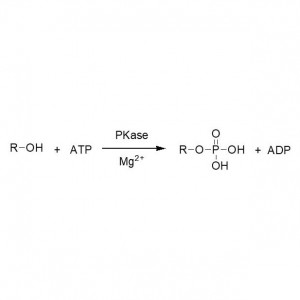
ຕົວຢ່າງ 1 (Aminolysis)(1):
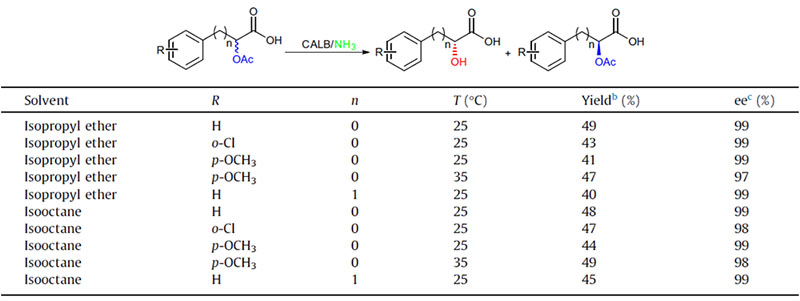
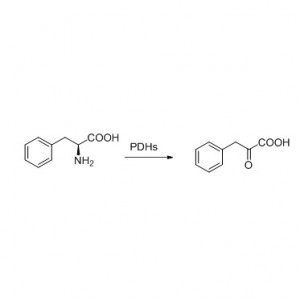
ຕົວຢ່າງ 2 (Aminolysis)(2):
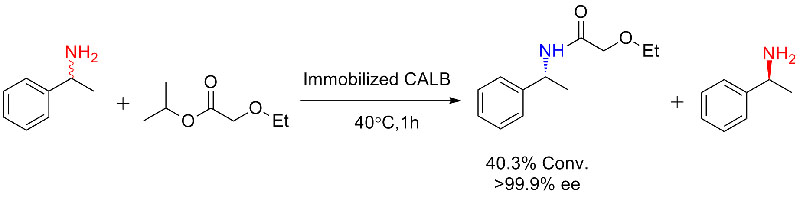
ຕົວຢ່າງ 3 (ການສັງເຄາະໂພລີເອສເຕຣຍເປີດວົງແຫວນ)(3):
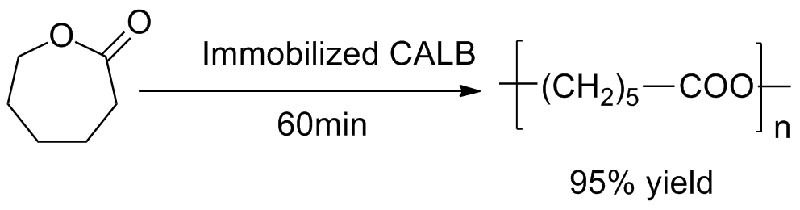
ຕົວຢ່າງທີ 4 (Transesterification, ການຄັດເລືອກຄືນໃໝ່ຂອງກຸ່ມ hydroxyl)(4):
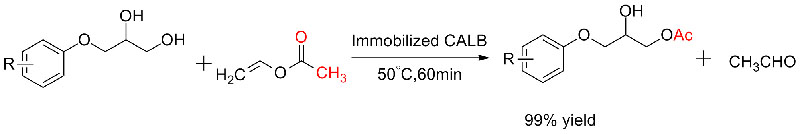
ຕົວຢ່າງ 5(Transesterification, ຄວາມລະອຽດ kinetic ຂອງເຫຼົ້າ racemic)(5):
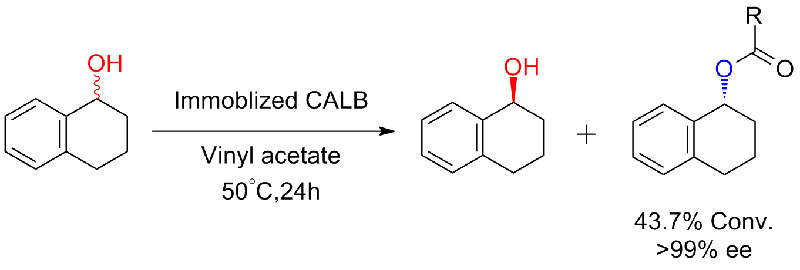
ຕົວຢ່າງທີ 6 (Esterification, ຄວາມລະອຽດ kinetic ຂອງອາຊິດ carboxylic)(6):
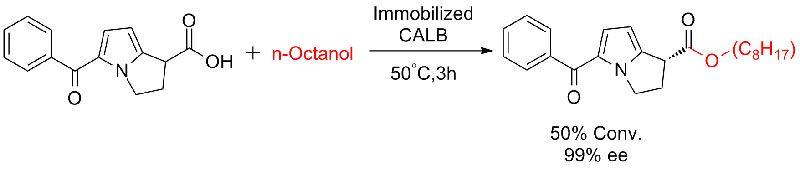
ຕົວຢ່າງ 7 (Esterolysis, ຄວາມລະອຽດ kinetic)(7):
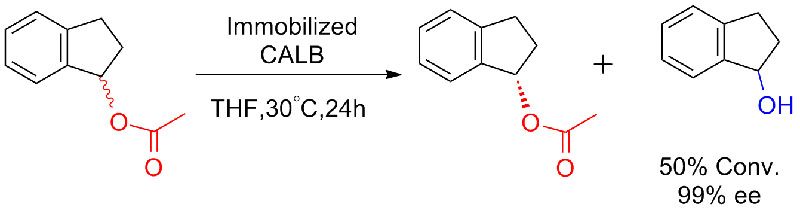
ຕົວຢ່າງ 8 (ການດູດນໍ້າຂອງອາມີດ)(8):
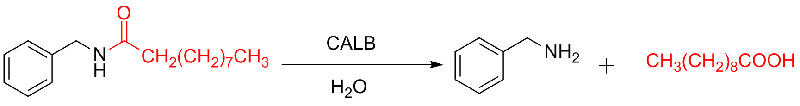
ຕົວຢ່າງ 9 (Acylation of amines)(9):
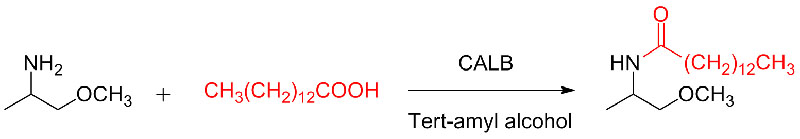

ຕົວຢ່າງ 10(ປະຕິກິລິຍາເພີ່ມເຕີມຂອງ Aza-Michael)(10):
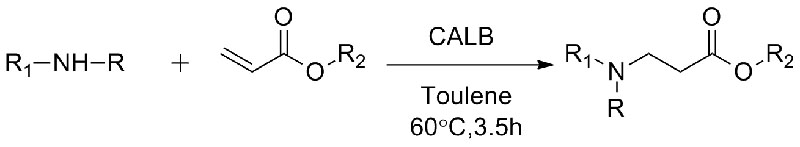
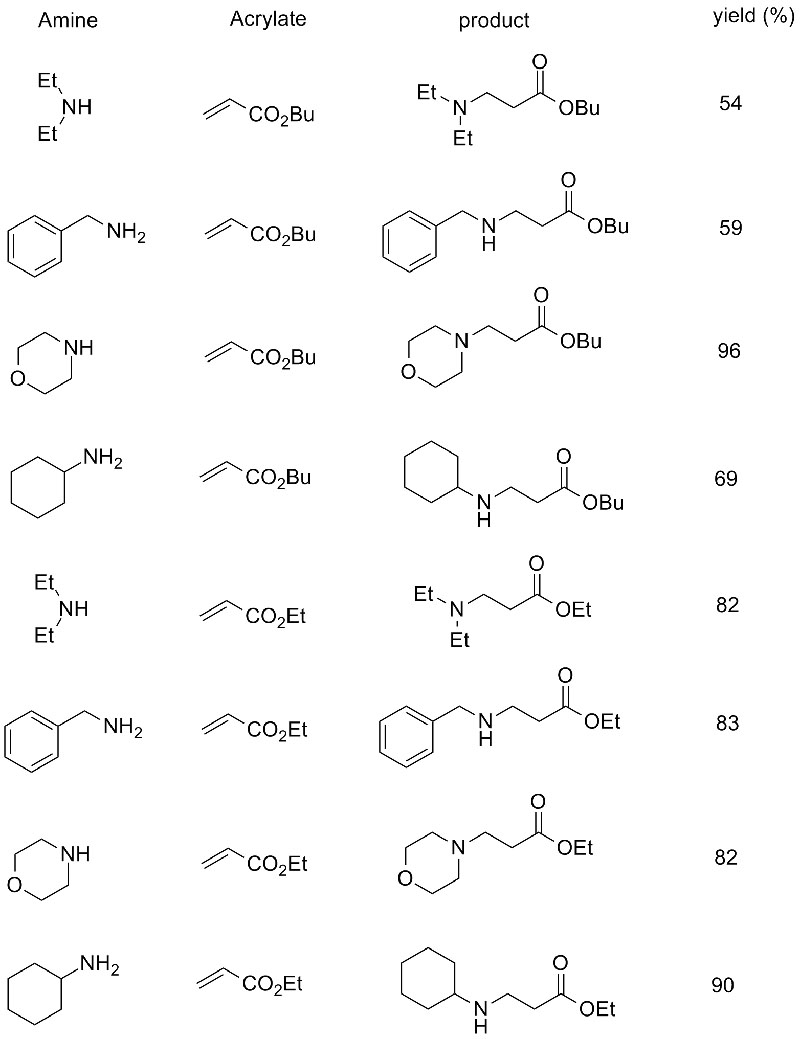
1. Chen S, Liu F, Zhang K, e tal.Tetrahedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, e tal.Tetrahedron, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, e tal.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, e tal.J. ໂມ.Catal.B: Enzym, 2016, 130: 58-69.
8. Gavi´an AT, Castillo E, L´opez-Mungu´AJ Mol.Catal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, e tal.J. ໂມ.Catal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, e tal.Tetrahedron Lett, 2010, 51: 4455-4458.